【從ISO 13528的一項要求標準談起】
2025/11/17
ISO 13528: Statistical methods for use in
proficiency testing by interlaboratory comparison,是能力試驗執行機構(PTP)統計分析能力試驗結果的一份指引。
其中9.2 (p.24)有一項要求標準:
u(xpt) < 0.3σpt or u(xpt) < 0.1δE (請參閱附圖)
(符號說明)
xpt
: 代表能力試驗物件的指定值;
u(xpt)
: 代表能力試驗物件指定值的標準不確定度 (standard
uncertainty of the assigned value); 可得自PT provider測試均勻度時所得的SD。
σpt: 代表能力試驗評鑑的標準偏差(standard
deviation for proficiency assessment; 參閱指引p.42的符號定義。即PT評估結果的SDI。
δE代表能力試驗結果的誤差允許範圍(an
allowance for measurement error);參閱指引的9.3.2和p.42的符號定義。 即TEa。
台灣醫檢學會的能力試驗總結報告說明中,將上一要求解釋為:
「本次測試件項目分析結果的標準不確定度估算小於0.3SD,可以忽略不計」。(參閱附圖)
但這句話語焉不詳,有值得討論的空間。
1.
「分析結果」是指甚麼的結果?
2.
SD是指甚麼的SD
【解讀】
1.
「分析結果」指的是均勻度測試的分析結果;
2.
「分析結果的標準不確定度」指的是均勻度測試的SD;
3.
「0.3 SD」/ 中的SD指的是結果統計的PSD。
【結論】
因為當物件的標準不確定度< 0.3
PSD,表示均勻度對結果統計的影響可以忽略不計。
若將學會報告中的該句話修正為:
「本次PT物件各項目均勻度測試的標準不確定度小於0.3 PSD,不影響最終評估結果。」語意更清楚,實驗室應可更了解其意義。
【提醒】
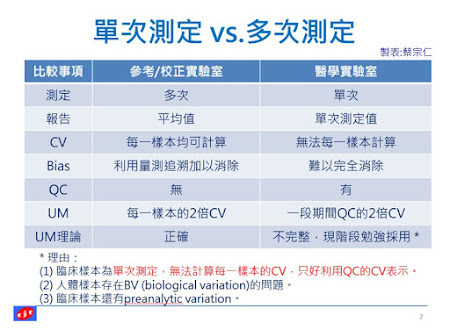
有些ISO給實驗室的指引,不一定適用於醫學實驗室,特別是有關量測不確定度的指引。因為樣本的檢測,醫學實驗室是單次測定,其他領域是抽樣後多次測定。量測不測定度的估算基礎並不相同。ISO 13528: Statistical methods for use in proficiency testing by
interlaboratory comparison中部分內容並不適用於醫學領域,特別是涉及測定次數的計算公式。